共价闭合、单链环状的RNA(CircRNA)是一类比较特殊的RNA,CircRNA没有5′帽子结构和3′poly(A)结构,并且对核酸酶不敏感,因此比普通的线性RNA(linear RNA)更稳定。circRNA主要位于细胞质中,并且可以被储存在外泌体中。早在二十年前,科学家已经在植物类病毒、酵母线粒体RNA以及乙型肝炎病毒中鉴定出CircRNA,随后在人的Ets-1基因以及小鼠的Sry基因中鉴定到内源的CircRNA,但是当时只鉴定出一小部分CircRNA,并且被当做是没有调控潜能的、发生异常剪切后的副产物。近年来,有研究发现由人的INK4a/ARF和CDR1基因环化而来的CircRNA对人的动脉硬化有影响并且参与调控mRNA的表达,为CircRNA研究提供了新的曙光。随着高通量测序以及生物信息分析的快速发展,在不同物种的细胞以及组织中鉴定出成千上万个circRNA的存在,目前在人中已经鉴定出14807个候选的circRNA,说明在人的转录组中,circRNA是一个比较大的RNA家族。尽管已经鉴定出大量的circRNA,但是关于circRNA的功能以及成环机制的研究才刚刚起步。CircRNA的种类按其来源可以归类为以下四种:
①全外显子型的circRNA;
②内含子和外显子组合的EICircRNA;
③内含子组成的套索型ciRNA;
④由病毒RNA基因组、tRNA、rRNA、snRNA等环化产生的circRNA。
到目前为止,已经发现的CircRNA的生物学功能主要有以下四种:
1.细胞核内参与转录调控有研究报道人细胞中由ANKRD52,MCM5, SIRT7的内含子环化而来的ciRNAs定位于细胞核中,而它们的亲本基因主要定位在细胞质中。研究发现敲除ciRNAs会导致它们的亲本基因的表达量显著下降,并且ciRNAs可以通过正调控RNA聚合酶II的转录从而顺式调控其宿主基因的表达。
2.转录时与mRNA前体发生剪切竞争CircRNA来源于mRNA前体,mRNA前体在加工过程中可以进行典型的线性剪切产生mRNA,也可以发生非典型剪切产生CircRNA。研究发现提高典型线性剪切的效率会导致产生CircRNA的数目显著减少,当外显子侧翼的内含子长度比较长时,发生典型线性剪切的效率显著下降,而发生环化的效率显著提高,说明转录时CircRNA可以与mRNA前体发生剪切竞争。
3.细胞质中与mRNA竞争miRNA的靶向结合位点除了小部分通过内含子环化产生的ciRNAs位于细胞核中,大部分的CircRNA主要定位于细胞质中,近年来,有大量的研究发现定位于细胞质中的CircRNA可以和mRNA竞争miRNA的靶向结合位点,从而调控mRNA的表达。研究发现CircRNA ciRS-7由正义链CDR1as产生,ciRS-7含有六十多个保守的miRNA miR-7的靶标结合位点,并且在细胞质中高丰度表达,在每个细胞中大概能吸附两万多个miR-7,因此可以和mRNA竞争miR-7的靶标结合位点,从而影响基因的表达(图1)。CircRNA和miRNA之间的互作是近年来研究的热点,但是目前只鉴定出少量的CircRNA包含多个miRNA的靶向结合位点。
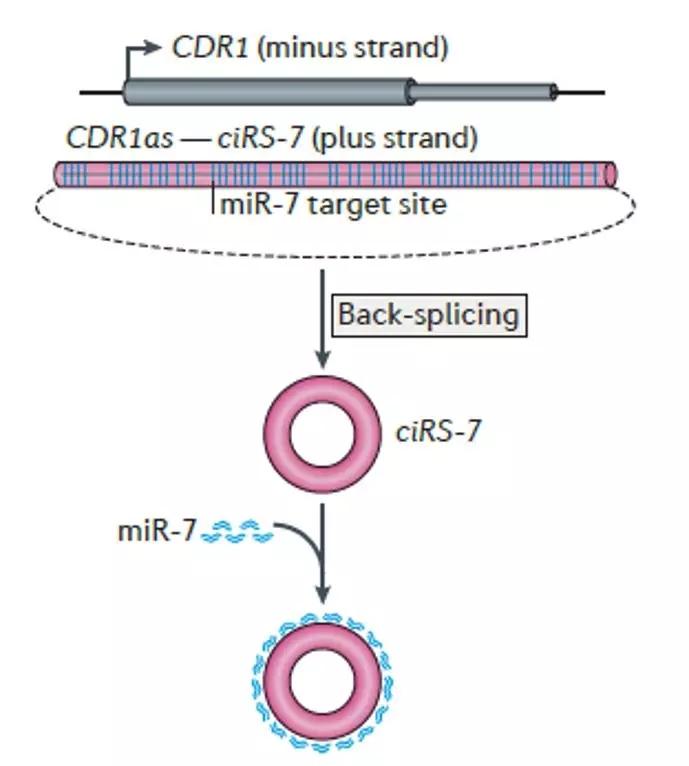
图1 ciRS-7与miR-7互作示意图
CircRNA最初被定义为非编码RNA,随着生物信息分析技术以及高通量测序技术的快速发展,有研究发现由ZNF609基因的二号外显子环化产生的 circ-ZNF609,其开放阅读框中包含起始密码子和终止密码子,进一步的蛋白质组学分析以及Western blot验证发现内源的circ-ZNF609具有翻译蛋白质的功能,但是翻译效率比线性RNA低两个数量级。另外有学者在果蝇的大脑组织中通过核糖体印记分析发现有些CircRNA可以结合到核糖体上,例如circMbl的终止密码子处包含核糖体结合位点,可以翻译表达有效蛋白。CircRNA编码蛋白功能的发现,为CircRNA的功能研究找到了一个全新的突破口。
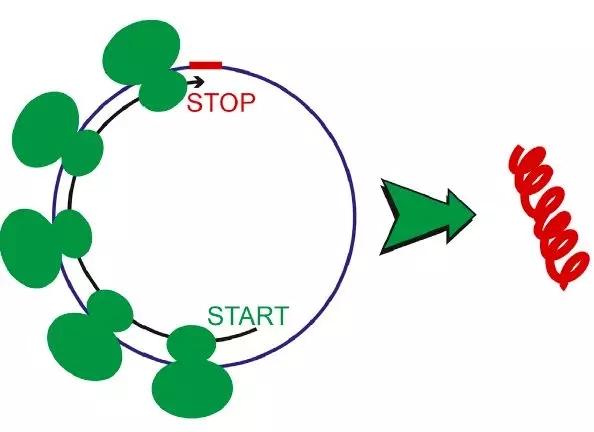
图2 circRNA翻译表达有效蛋白示意图
CircRNA的环化方式可以分为两种:内含子环化和外显子环化,CircRNA的种类很多,不同类型的CircRNA成环机制不同,目前已经发现的成环机制主要有以下三种:
1.依赖于剪切体的索尾插接环化真核生物转录组中,通过外显子索尾插接环化形成CircRNA是最早发现的也是最常见的一种CircRNA成环方式。研究发现80%以上CircRNA包含外显子,外显子索尾插接环化依赖于典型的剪切体机制。在mRNA前体上,通过连续的组装小核核糖体蛋白从而催化外显子下游的5′供体位点连接到上游的3′受体位点,形成索尾插接环化,然后通过剪切形成CircRNA ,但是剪切体催化索尾插接环化的具体机制目前还不清楚(图3 a)。
2.顺式作用元件促进CircRNA形成CircRNA中通常包含2-3个外显子,最近有研究发现哺乳动物和秀丽隐杆线虫中大多数CircRNA以及黑腹果蝇中部分CircRNA外显子两侧的内含子中含有反向互补序列,这些互补序列在剪切位点上并排形成RNA双链体,最后通过可变剪切形成带内含子和不带内含子两种不同的CircRNA(图3 b)。通常长度在30到40的核苷酸序列就可以促进CircRNA的环化,例如灵长类中的Alu元件。另外有研究发现外显子内部以及两侧的内含子可以竞争进行RNA配对,最终通过可变剪切形成不同类型的CircRNA(图3 c)。
3.RNA结合蛋白(RBPs)调控CircRNA形成除了mRNA前体以及顺式作用元件之外,RNA结合蛋白(RBPs)也参与调控CircRNA的生物起源,例如黑腹果蝇中,Mbl蛋白可以通过结合到外显子侧翼的内含子上,从而促进CircRNA的形成(图3 d);上皮间质转化过程中,当QKI蛋白的表达量比较高时,形成mRNA,而高表达的QKI蛋白可以结合到外显子侧翼的内含子上,使外显子并排从而促进环化(图3 e);与QKI蛋白的作用效果相反,高表达量的ADAR1蛋白可以通过破坏外显子侧翼的RNA配对从而抑制CircRNA的形成(图3 f)。
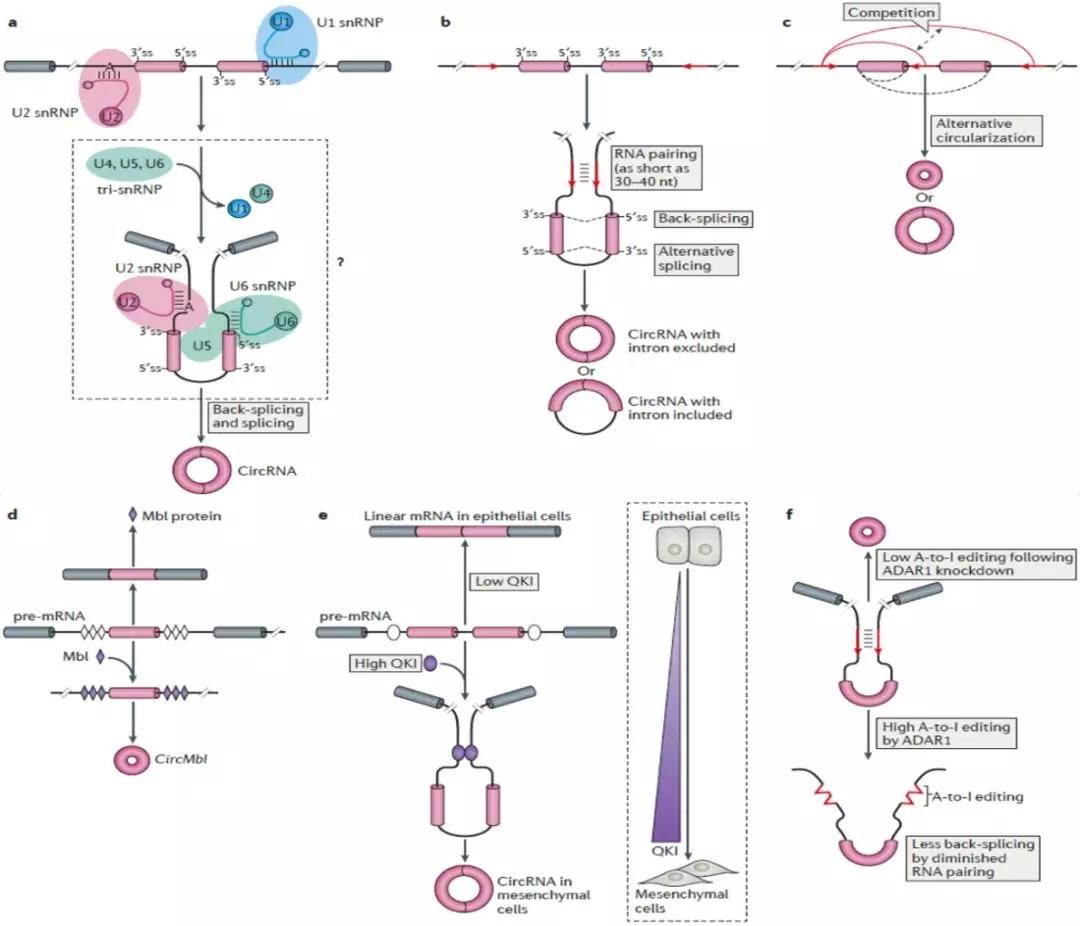
图3 CircRNA成环机制
CircRNA鉴定技术
CircRNA的生物信息分析鉴定目前采用CIRCExplore软件,分析流程可以分为三步(见图4)。
Step1:测序后的Reads经过TopHat比对之后,把没有比对上基因组的Reads用TopHat-Fusion和注释的back-spliced junctions位点序列进行比对。由于某些外显子末端的序列比较相似,因此会导致比对后的junction reads在错误的位置被分开,最后比对到错误的位点(红色的bar)。
Step2:对junction reads进行重新排列,用自定义的算法对上一步的错误比对进行校正。
Step3:结合预测的back-spliced exons(蓝色的bar)和预测的junction reads对CircRNA进行注释。
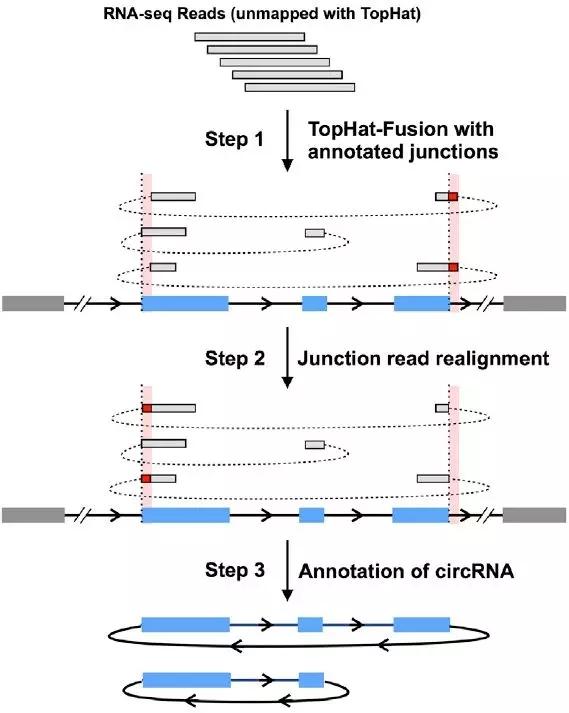
图4 CircRNA鉴定技术流程
CircRNA后期验证
通过二代测序和生物信息分析鉴定出来的CircRNA,后期需要通过实验进一步验证CircRNA的存在及其生物学功能。目前CircRNA的验证方法主要有以下几种:
(1)qRT-PCR定量验证CircRNACircRNA定量验证主要通过分离得到非多聚腺苷酸化RNA或去rRNA后 的RNA、用RNase R去除线性RNA、随机引物反转录成cDNA、RT-PCR扩增、PCR产物跑胶验证、PCR产物测序验证等技术手段,其中最关键的步骤是针对CircRNA设计特异性的RT-PCR引物。CircRNA的环化方式有两种:内含子环化(ciRNA)和外显子环化(CircRNA),通过外显子环化产生的CircRNA除了back-spliced junction位点处与线性RNA不同外,其他区域是一致的,因此可以针对CircRNA的back-spliced junction位点设计特异性的引物(divergent primers)(见图5),divergent primers可以通过网站直接进行设计。
http://circinteractome.irp.nia.nih.gov/Divergent_Primers/divergent_primers.html
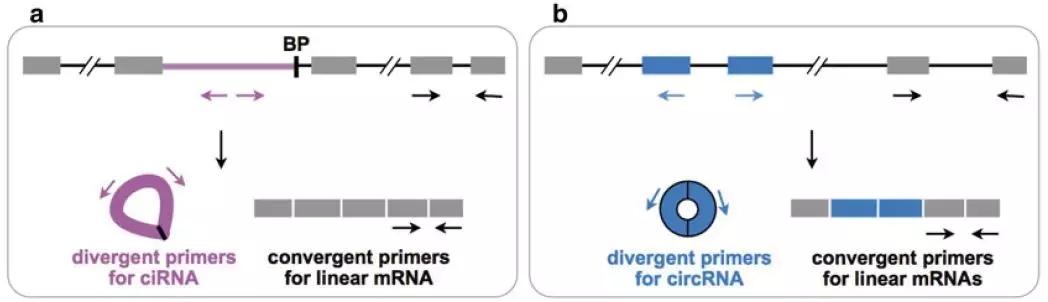
图5 CircRNA定量验证引物设计示意图
(2)Northern blot验证CircRNANorthern blot验证CircRNA主要通过分离得到非多聚腺苷酸化RNA或去rRNA后的RNA、用RNase R去除线性RNA、变性聚丙烯酰胺凝胶电泳(PAGE)等技术手段来验证。其中根据CircRNA环化的方式设定探针序列是至关重要的步骤。对于内含子环化产生的ciRNA,可以根据内含子序列设计探针(图5 a);对于外显子环化产生的CircRNA,尽可能跨越backsplice junction位点设计探针(图5 b)。验证策略是对基因组DNA、总RNA以及CircRNA(DNA free、rRNA free、linearRNA free)同时进行杂交验证。
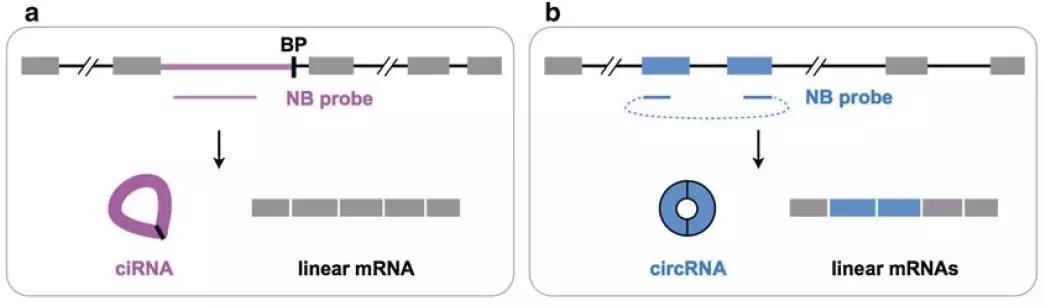
图6 Northern blot探针设计示意图
(3)过表达验证CircRNACircRNA的成环机制有很多,其中基于CircRNA侧翼的反向互补序列(Alu序列)是目前公认的一种成环机制。因此我们可以通过PCR扩增目标区域(包含CircRNA侧翼的Alu元件或者内部的碱基互补序列)、根据限制性酶切位点进行酶切并连接到载体上;过表达载体转染;定量PCR检测转染效率;divergent primers鉴定CircRNA过表达倍数等技术手段验证CircRNA。过表达策略:
1. 扩增目标区域包含circRNA侧翼Alu序列或内部碱基互补序列,侧翼上下游1kb处过表达效率更佳;
2. 目标区域扩增基于基因组DNA为模版。
(4)RNA验证CircRNA和过表达策略相反,我们可以采用RNA干扰技术验证CircRNA。对于内含子环化产生的ciRNA,可以根据内含子序列设计相应的siRNA进行干扰,对于外显子环化产生的CircRNA,可以根据backsplice junction位点处序列信息设计siRNA,最后通过divergent primers鉴定CircRNA敲除倍数。验证策略:可以同时设计三种siRNA,一种是和CircRNA backsplice junction位点靶标结合的siRNA,可以特异性干扰CircRNA的表达;一种是和linear RNA靶标结合的siRNA,可以特异性干扰linear RNA的表达;还有一种是和CircRNA、linear RNA共有的外显子序列结合的siRNA,可以同时干扰CircRNA和linear RNA的表达。
(5)荧光原位杂交定位CircRNA位于细胞核中的ciRNAs主要调控亲本基因的表达,而位于细胞质中的CircRNA主要发挥竞争性内源RNA(ceRNAs)的作用,一般采用荧光原位杂交技术(FISH)对CircRNA进行定位,以便于后续功能的进一步研究,设计的杂交探针需要跨越backsplice junction位点。
(6)荧光素酶报告基因检测CircRNA报告基因表达系统是将报告基因的编码序列与目的基因相结合,将结合基因进行表达,通过检测报告基因的表达产物来测定目的基因的表达量。荧光素酶报告基因系统是以荧光素为底物通过荧光测定仪检测生物荧光进而检测荧光素酶的活性,荧光素和荧光素酶这一生物发光体系,可以极其灵敏、高效地检测基因的表达。
(7)CircRNA翻译功能验证CircRNA包含核糖体进入位点,可以翻译表达有效蛋白是最近研究的热点,circRNA翻译功能的验证可以通过NGS和生物信息学方法(翻译组学)对ORF进行预测;外源性功能验证可以通过人工合成小circRNA或者是荧光报告基因对circRNA进行验证;内源性功能验证可以通过Minigene表达载体、蔗糖密度梯度实验、质谱鉴定等方法对circRNA进行验证。其中Minigene表达载体包含circRNA的表达框:外显子侧翼的反向互补序列以及促使环化剪切的介导序列。Minigene表达载体转染到细胞中可以主动成环,因此是内源性的circRNA的模拟物,转染后可以通过定量PCR检测转染效率,divergent primers鉴定CircRNA表达量。
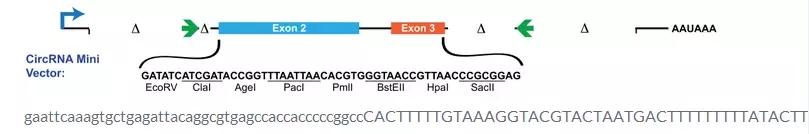
图7 circRNA Mini表达载体结构
1. Ashwal-Fluss R, Meyer M, Pamudurti N R, et al. circRNA Biogenesis Competes with Pre-mRNA Splicing[J]. Molecular Cell, 2014, 56(1):55-66.
2. Chen L L. The biogenesis and emerging roles of circular RNAs[J]. Nature Reviews Molecular Cell Biology, 2016, 17(4):205.
3. Chen L L, Yang L. Regulation of circRNA biogenesis[J]. Rna Biology, 2015, 12(4):381.
4. Jeck W R, Sorrentino J A, Wang K, et al. Circular RNAs are abundant, conserved, and associated with ALU repeats[J]. Rna-a Publication of the Rna Society, 2013, 19(2):141-157.
5. Legnini I, Timoteo G D, Rossi F, et al. Circ-ZNF609 Is a Circular RNA that Can Be Translated and Functions in Myogenesis[J]. Molecular Cell, 2017, 66:22–37.e9.
6. Panda A C, Abdelmohsen K, Gorospe M. RT-qPCR Detection of Senescence-Associated Circular RNAs[M]// Oncogene-Induced Senescence. Springer New York, 2017.
7. Pamudurti N R, Bartok O, Jens M, et al. Translation of CircRNAs.[J]. 2017.
8. Zhang X O, Wang H B, Zhang Y, et al. Complementary Sequence-Mediated Exon
Circularization[J]. Cell, 2014, 159(1):134.
9. Zhang Y, Yang L, Chen L L. Characterization of Circular RNAs[J]. Methods in
Molecular Biology, 2016, 1402(1):215.
10. Zhang Y, Zhang X O, Chen T, et al. Circular Intronic Long Noncoding RNAs[J].Molecular Cell, 2013, 51(6):792–806.
