Janus激酶/信号转导与转录激活子(The Janus kinase/signal transducer and activator of tran-scriptions, JAK/STAT)信号通路是众多细胞因子信号转导的共同途径,广泛参与细胞增殖、分化、凋亡以及炎症等过程,可以通过负调节因子与其他信号通路相互作用、STATs共价修饰等多种途径进行调节。JAK/STAT通路的激活促进各种疾病的发生、发展,包括各种炎症性疾病、淋巴瘤、白血病以及实体肿瘤等疾病,针对JAK/STAT信号通路的靶向治疗是目前的热点,本文主要就“JAK/STAT信号通路调节机制”及针对此通路的靶向治疗的相关进展做一综述。
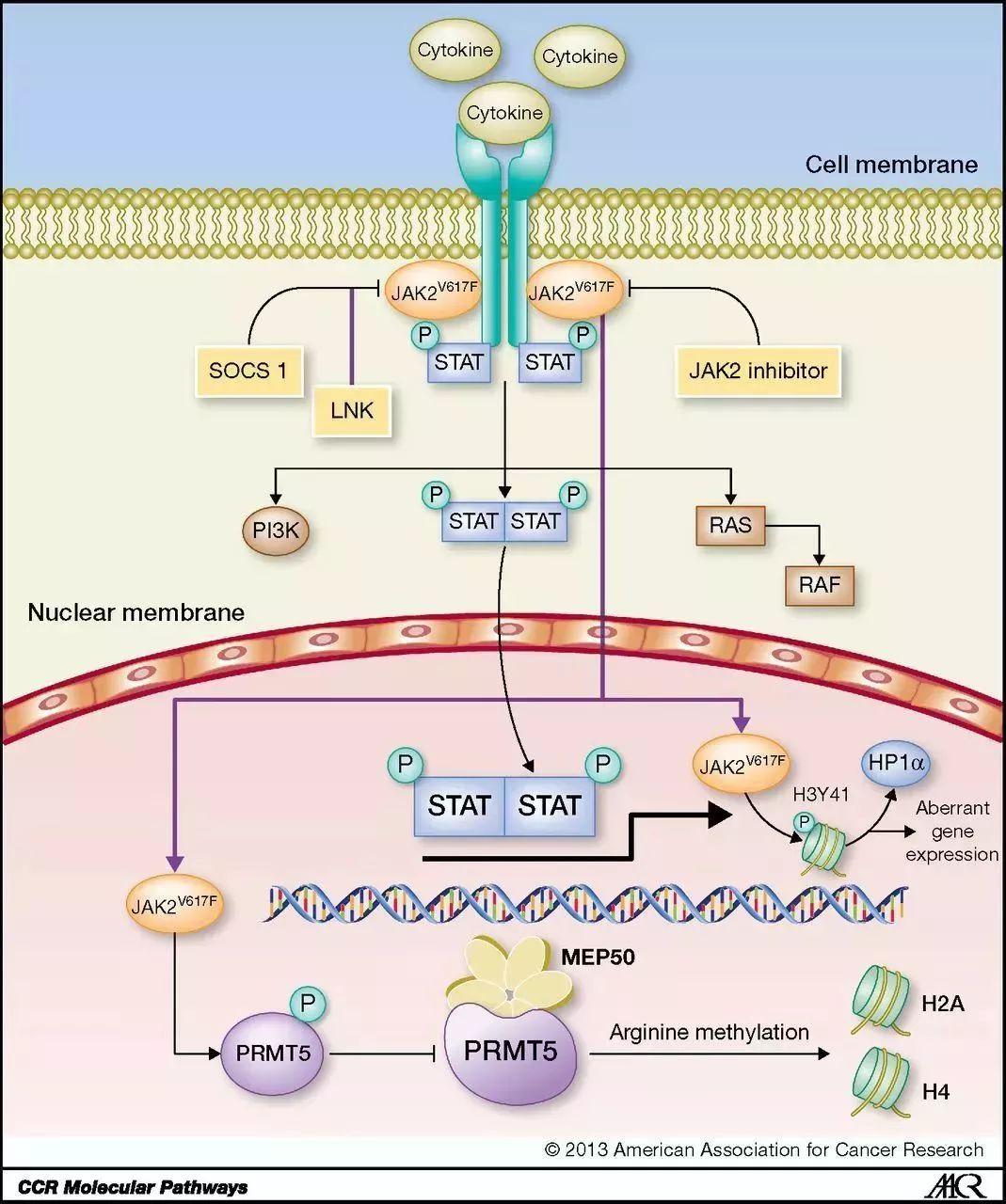
1.JAK/STAT信号通路的构成及传递过程
哺乳动物有4个JAKs和7个STATs。JAKs是一类非受体型酪氨酸激酶,包括 JAK1、JAK2、 JAK3 和 Tyk2四个成员。JAKs的分子量在120-140kDa之间,每个JAKs成员具有7个保守的结构域,无跨膜结构域。C- 末端JH1、JH2域具有催化功能,N- 末端的4个JH域不具有酪氨酸激酶活性,可能参与JAKs及其它信号蛋白分子的结合。研究表明,细胞因子与JAKs之间并不存在一一对应的关系,即一种细胞因子可以激活多种胞内的JAKs,或多种细胞因子同时激活相同的JAKs发挥生物学效应。
STATs的发现源于对干扰素信号转导机制的研究。研究发现STATs包括STAT1、2、3、4、5a、5b 和 6 这七个成员。STAT蛋白由6个功能区组成:氨基末段结构域、卷曲螺旋结构域、DNA结合域 (DNA-binding domains,DBD)、Src同源2区(Src homology 2 domain ,SH2)结构域、酪氨酸激活域、转录激活域 (transcriptional activation domains,TAD)。氨基末段结构域在结构上独立,可以使未活化的STATs形成同源二聚体,研究表明这个结构域在入核转运过程中协同DNA结合域结合到串联的GAS元件。卷曲螺旋结构域由一个4-α- 螺旋束组成,该结构域提供了大量亲水性的表面,并结合调节因子。DNA结合域是由一个 β- 免疫球蛋白折叠构成,可以直接结合到增强子GAS家族。SH2结构域是一个高度保守的结构域,可与细胞因子受体酪氨酸磷酸化特异性结合,因此决定细胞因子与STATs结合的特异性。酪氨酸激活域直接和SH2结构域相邻,可以阻止自身磷酸化。C- 末端残基组成了转录激活域,不同的STATs成员之间有很大的差异,这使得STATs可以和各种不同的转录调节相关联。
JAK / STAT信号通路基本传递过程是:细胞因子与其受体结合后引起受体分子的二聚化,使得与受体偶联的JAKs相互接近并通过交互的酪氨酸磷酸化而活化,活化的JAKs催化受体本身的酪氨酸磷酸化并形成相应的STATs停靠位点,使STATs通过SH2结构域与受体结合并在JAKs的作用下实现其磷酸化活化,然后STATs形成同 / 异二聚体并入核,与相应的靶基因启动子结合而激活相应的基因转录和表达。
2.JAK/STAT信号通路的调控
2.1 JAK/STAT信号通路负调节因子
JAK-STAT信号通路的特征就是迅速的激活和失活。激活的STATs迅速地在细胞核内聚集,在几个小时内,失活的STATs又重新回到细胞质为激活下一轮信号通路做准备,这种失活引起了受体、JAKs以及STATs活性的下调。目前有研究表明,在果蝇中发现未激活STAT3也可以进入细胞核并作用于靶基因产生生物学活性,但机制尚不清楚。
JAK/STAT的负调节主要涉及以下三个负调节因子:细胞因子信号转导抑制蛋白 (suppressors of cytokine signaling、SOCS)、活化STATs蛋白抑制因子(protein inhibitors of activated stats、PIAS)、蛋白酪氨酸磷酸酶(protein tyrosine phosphatases、PTPs)。另外还有很多负性调节因子被报道,包括STAT1/3/5 C- 端缺失突变体、酪氨酸磷酸化抑制剂AG-490、环腺苷酸(cyclic AMP,c AMP)等。
2.1.1 SOCS家族
目前发现SOCS家族至少由8个成员组成:SOCS1~SOCS7及细胞因子可诱导含SH2蛋白 ( cytokine inducible SH2 containing protein, CIS)。SOCS家族成员结构相似,均含有氨基酸长度不等的N端、中央SH结构域、由40个氨基酸组成的C端保守序列,即SOCS盒。SOCS被认为是STATs靶基因,可以直接对抗STATs活化,产生经典的反馈回路。活化的STATs刺激SOCS基因转录,使SOCS蛋白结合到磷酸化的JAKs和受体从而使通路关闭。在20世纪90年代后期,Yoshimura和他的同事们首先提出SOCS3或SOCS1的过度表达导致p-JAKs及p-STATs递减,确定了参与这一过程的SOCS1和SOCS3的SH2结构域的上游区域的12个氨基酸,并推测这两个SOCS蛋白可能直接结合JAKs,并抑制其催化活性。有生化和结构数据支持Yoshimura的假说并发现SOCS3抑制JAKs的分子机制。他们使用纯化的重组酶(JAK2激酶结构域),底物(gp130细胞质结构域)和抑制剂SOCS3所组成的体外激酶测定系统,证实SOCS3抑制JAK2的催化域JH1,SOCS3与JAKs直接作用,而不是与底物。SOCS3主要使用疏水性的表面锚定到的JAK2的催化结构域,通过将KIR (KIR是残基22-29,在缺乏JAKs的时候结构松散的)放置到底物结合槽来抑制酶活性。KIR的第一个残基占据JAKs“ P +1 ” 结合口袋,残基C端迅速与底物酪氨酸结合,因此推测SOCS3通过阻断底物和JAK结合来抑制JAKs活性。
目前认为SOCS可以通过三种途径进行负反馈调节:
1.通过结合受体上的磷酸化酪氨酸,SOCS物理性阻断STATs与受体的结合;
2.SOCS可以直接结合JAKs或受体从而特异性地阻断JAKs活性;
3.SOCS通过C- 末端同源区即SOCS盒与延伸蛋白( elongin) B /C复合体相互作用。
elongin B /C是一种泛酸酶的组成部分,将SOCS结合的信号因子(如JAKs和STATs等)通过泛酸化途径降解,从而阻断细胞因子的信号传递。基因的靶向研究已表明SOCS-1、SOCS-2 、SOCS-3、CIS可以对抗干扰素(Interferon,IFN)-γ/STAT1、白介素(Interleukin, IL)-12/STAT4、IL-4/STAT6、生长激素 (growth hormone,GH) /STAT5和IL-6/STAT3的效应。CIS是SOCS家族中的一员,与SOCS2具有高度同源性。CIS1作为IL-3和红细胞生成素信号转导抑制子最早被发现,CIS1转基因小鼠表现出IL-2和催乳素信号转导缺陷,类似的情况在STAT5缺陷小鼠中也被发现。研究表明,CIS1的启动子区域有STAT5反应元件,CIS1基因的表达要依赖STAT5,但生成的CIS1又反过来负性调节STAT5的活性。SOCS的其他成员仍了解很少,有待于更多的实验研究深入探讨其具体作用机制以及功能。
2.1.2 PIAS家族
PIAS家族包括:PIAS1、PIAS3、PIASx (PIASx A、PIASx B)、PIASy。 通过免疫共沉淀及功能分析说明PIAS1和PIAS3分别为STAT1、STAT3的特异性抑制子 。PIAS在中心部位有一个锌指结构域, N端有个非常保守的SAP域,还有一个不保守的羧基域与靶蛋白结合,PIAS具有E3小泛素相关修饰物( small ubiquitin-related modifier , SUMO )连接酶样作用,可以修饰STATs的磷酸化位点,通过阻断STATs的DNA结合活性从而抑制STATs介导的信号传导。PIAS对STATs的这种抑制作用一方面是通过与二聚化的STATs结合,掩盖STATs的DNA结合区;另一方面是通过与STATs单体结合阻碍其二聚化而实现。与SOCS家族不同,PIAS蛋白的产生不受细胞因子的诱导,而天然存在于胞浆中,持续调节活化的STATs的数量,从而调节相应细胞因子的生物学活性 。
2.1.3 PTPs家族
PTPs家族负调节因子中最简单的就是PTPs,它可以阻断JAKs活性。PTPs包括SHP2、SHP1、CD45、PTP1B、T-cell PTP (TC-PTP)、PTPRT、PTPBL等。它们当中最经典的就是Src同源2区蛋白酪氨酸磷酸酶 (Src homology2 domain-containg protein tyrosine phosphatase,SHP-2),小鼠motheaten基因的产物。SHP2包含两个串联SH2结构域(N-SH2和C-SH2)、一个经典的酪氨酸磷酸酶域的C- 末端,C- 末端尾部有两个重要的酪氨酸(Tyr542和Tyr580)和一些其他的功能性序列。SH2结构域,尤其是N-SH2结构,可以识别磷酸化酪氨酸残基上的其他分子,调解SHP2和这些分子之间的相互作用。蛋白酶诱导和抵抗实验表明C- 末端的Tyr542和Tyr580磷酸化调节SHP2活性。Tyr542和Tyr580磷酸化还参与N-SH2和C-SH2结构域,刺激SHP2活动。研究表明,SHP2通过使STAT1脱磷酸负性调节INF诱导的JAK/STAT信号通路。SHP2以酪氨酸***酶依赖的方式和STAT5a相互作用,体外的酪氨酸***酶定量测定显示纯化的SHP2直接使STAT5脱磷酸化。 SHP2还负性调节STAT3的活性,STAT3是一个非常重要的信号蛋白,参与维持胚胎干细胞的自身更新以及细胞因子所产生的造血细胞反应。SHP1包含2个SH2域,可以结合到磷酸化的JAKs或者受体,使这些活化的信号分子脱磷酸化。其它的酪氨酸磷酸酶,如CD45,可以通过相应的受体来调节JAK/STAT信号通路,CD45高表达于造血细胞中,可以抑制JAKs激酶使之去磷酸化,且能特异性使JAK1的Tyr去磷酸化。
2.1.4 其他STAT1和 STAT3
通过选择性剪接产生C- 端缺失突变体,它们也可在细胞因子诱导下发生酪氨酸磷酸化,并可与野生型蛋白形成异源二聚体入核与DNA结合。但这种异源二聚体无转录激活功能,可对JAK/STAT途径起负调节作用。AG-490是一种去C- 末端的JAKs,是JAK2、JAK3的化学抑制剂,它能抑制它们的酪氨酸磷酸化,还能抑制STAT1、3、5a、 5b与DNA的结合活性。cAMP能抑制IL-6诱导的STAT1、STAT3与DNA的结合。
虽然JAK/STAT信号通路在理论上较为简单。但可以和其它通路相互作用产生复杂的生物学作用。这些通路之间的关系非常复杂,它们路径在多个层次相互交叉,彼此互相活化。活化的JAKs磷酸化它们相关受体的酪氨酸,使之成为来自其它通路中含有SH2域蛋白的停靠点,这些蛋白包括SHP-2和Src同源胶原蛋白(Src homology collagen protein,SHCP)等,它们可以招募Grb2从而激活Ras信号通路。JAK/STAT通路还可以通过SOCS3间接地激活Ras通路,SOCS3结合并减弱Ras GAP(Ras通路的一个负调节因子)的活性从而促进Ras通路的激活。大量的研究表明STATs的激活可以通过受体酪氨酸激酶(Receptor Tyrosine Kinases,RTK)而不是JAKs,RTK可以通过两种机制激活JAK/STAT信号:(1)一些RTKs的活化,包括表皮生长因子受体(epidermal growth factor receptor , EGFR) 和血小板衍生生长因子受体 ((platelet-derived growth factor receptor,PDGFR),导致不依赖JAK而通过Src激酶造成STATs酪氨酸磷酸化;(2)RTK/Ras通路的激活引起丝裂原活化蛋白激酶(Mitogen Activated Protein Kinase ,MAPK)活化的上调,MAPK特异性地磷酸化大部分STAT C- 端的一个丝氨酸 (Ser),Ser磷酸化极大地增强了STATs的转录活性。
除了Ras和RTK与JAK/STAT通路相互作用,还有报道肿瘤坏死因子(tumor necrosis factor,TNF)-β 信号通路在多个层次与JAK/STAT相互作用。而且活化STATs的功能可以通过与其它通路的转录因子和辅助因子相互作用而改变。因此,细胞因子产生的生物学作用必须考虑众多信号通路之间的相互作用。
2.2 STAT共价修饰
STAT的共价修饰除了典型的酪氨酸磷酸化,还包括丝氨酸磷酸化,乙酰化,糖基化、泛素化等。
2.2.1 丝氨酸磷酸化
除了STAT2,其它STATs的TAD至少有一个丝氨酸残基磷酸化。保守的磷酸化位点包括STAT1和STAT3的Ser727、STAT4的Ser721S、STAT5a的Ser725、STAT5b的Ser730、STAT6的Ser756。STAT1和STAT5至少还具有一个额外的丝氨酸磷酸化位点,分别为Ser708和Ser779。STAT丝氨酸蛋白激酶通过使用抑制剂、负相显性等位基因、体外激酶测定等方法已明确,它们包括:MAPK、蛋白激酶Cδ (Protein kinase Cδ,PKCδ)、哺乳动物雷帕霉素靶 (mammalian target of rapamycin,m TOR)、NEMO样激酶 (NEMO-like kinase,NLK)、钙调蛋白、依赖性蛋、白激酶II (calmodulin-dependent protein kinase II, Ca MKII)和IκB激酶 ε (IκB kinaseε,IKKε)。STAT丝氨酸磷酸化调节转录活性,STAT1-S727A突变小鼠表现出缺乏IFN介导的天然免疫。 STAT3-S727A突变小鼠围产期致死率为75%,生长发育迟缓, 而STAT3对照组没有表现出明显的生物学缺陷。同样,IL-12诱导T细胞产生IFN-γ,而在STAT4-S721突变的T细胞,这种作用受到减弱。在Toll样受体(Toll-like receptor,TLR)、IL-1R或TNFR刺激以及缺乏酪氨酸磷酸化的情况下,STAT1的Ser727磷酸化,通过抑制其他转录因子来调节转录,如核因子 -κB(nuclear factor-kappa B,NF-κB)来调节转录。研究表明,STAT1依赖性凋亡反应需要Ser727的磷酸化,而不是酪氨酸磷酸化。
2.2.2 乙酰化
STAT1、STAT2、STAT3、STAT5b、STAT6已确定可产生乙酰化,乙酰化的调节有赖于组蛋白脱乙酰化酶(Histone deacetylase,HDACs)和组蛋白乙酰转移酶(如CBP/p300蛋白)之间的平衡。STAT1和STAT3的乙酰化对应NF-κB信号的改变,STAT1的赖氨酸乙酰化产生了促凋亡作用,而STAT3赖氨酸乙酰化产生抗凋亡作用,STAT3的乙酰化还调节同型二聚体的的转录活性和稳定性。
2.2.3 糖基化
STAT5和辅激活因子CBP的亲和力增加是与STAT5上的苏氨酸(Thr)92的糖基化相关联这个糖基化位点还保留在STAT1,STAT3和STAT6。
2.2.4 泛素化
研究表明,泛素 - 蛋白酶体途径与JAK2的降解有关,未受刺激的细胞JAK2是单体泛素化的,而IL3或IFN-γ 刺激诱导JAK2的聚泛素化,聚泛素化的JAK2通过蛋白酶体迅速被降解。另有研究表明,IFN-α 或过度表达的JAK2可以诱导肿瘤坏死因子受体相关因子6(TRAF6),从而增强STAT3蛋白的泛素化、抑制其转录活性,下调两个已知的STAT3的靶基因(CRP和ACT)的表达。
相关阅读推荐
新研究 | Nature:中科院药物所用最强激光照亮细胞信号通路
